Hormones and Behavior, settembre 2020
Maschi e femmine: uno studio sui meccanismi che regolano le differenze sessuali dell’attività cerebrale
Le differenze di sesso influenzano il cervello, il comportamento, le funzioni metaboliche e contribuiscono alla vulnerabilità alle malattie. Tuttavia, i meccanismi alla base delle differenze sessuali dell'attività cerebrale sono ancora poco noti.
Le nostre ricercatrici del gruppo di Neuropsicofarmacologia hanno analizzato l'inattivazione condizionale del gene Npy1r nei topi, osservando che induce differenze legate al sesso delle funzioni metaboliche e comportamentali.
IlariaBertocchi abc1, AlessandraOberto abc1, AngelaLongo a, PaolaPalanza d, CarolaEva abc
Le differenze di sesso influenzano il cervello, il comportamento, le funzioni metaboliche e contribuiscono alla vulnerabilità alle malattie; tuttavia, i meccanismi alla base delle differenze sessuali dell'attività cerebrale sono ancora poco noti. In alcuni studi su modelli animali sono state riportate differenze nell’espressione genica in base al sesso, smascherando delle popolazioni neuronali implicate nelle differenze comportamentali di risposta allo stress e della regolazione del metabolismo energetico nei maschi e nelle femmine.
L’interazione funzionale tra fattori biologici, psicologici e ambientali differiscono nei maschi e nelle femmine e lo stesso vale per il loro impatto sui circuiti omeostatici che regolano le funzioni fisiologiche, sia normali che patologiche. Per cui, considerando il loro grande contributo nella fisiologia e nel comportamento degli animali, le differenze di sesso dovrebbero essere prese in considerazione più spesso negli studi che utilizzano animali geneticamente modificati, così come negli studi clinici.
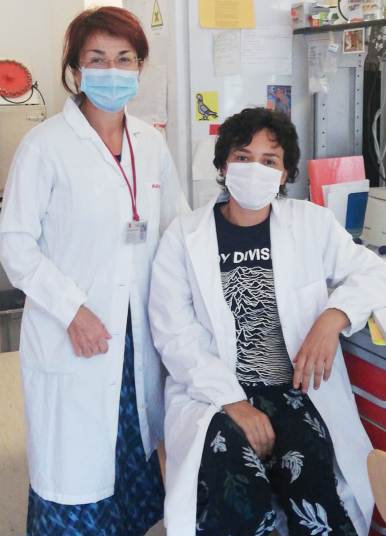
Il sistema del neuropeptide Y e del suo recettore principale Y1 (sistema NPY-Y1R) è sessualmente dimorfico e sensibile agli ormoni gonadici. In questo studio, pubblicato sulla rivista Hormones and Behavior, Ilaria Bertocchi e Alessandra Oberto (rispettivamente a destra e a sinistra nella foto) del nostro gruppo di ricerca di Neuropsicofarmacologia guidato dalla prof.ssa Carola Eva, hanno confrontato il fenotipo di topi knockout condizionali maschi e femmine (topi Npy1rrfb), in cui avviene l'inattivazione del gene Npy1r per Y1 nei neuroni eccitatori del sistema limbico cerebrale.
I topi maschi Npy1rrfb hanno mostrato un’iperattivazione dell'asse ipotalamo-ipofisi-surrene (HPA) associata ad ansia, disfunzioni esecutive ed alla riduzione della crescita del peso corporeo, della rialimentazione dopo ad un periodo di digiuno, del peso del tessuto adiposo bianco (WAT) e dei livelli di leptina plasmatica rispetto ai loro fratellicontrollo (Npy1r2lox). Al contrario, le femmine di topo Npy1rrfb hanno mostrato un comportamento ansioso ma nessuna differenza nell'attività dell'asse HPA, nelle funzioni esecutive e nel peso corporeo rispetto alle femmine di controllo.
Inoltre, l'inattivazione condizionale del gene Npy1r ha indotto,sempre nelle femmine,un aumento del peso del WAT sottocutaneo e gonadico e dei livelli di leptina plasmatica e una diminuzione compensatoria dell'immunoreattività di AgRP nel nucleo arcuato ipotalamico (ARC). È interessante notare che l'espressione dell'mRNA di Npy1r è stata ridotta dal knockout nell'ARC e nei nuclei ipotalamici paraventricolari di topi femmine, ma non nei maschi. Questi risultati hanno dimostrato una resistenza agli effetti ormonali e metabolici dell'inattivazione del gene limbico Npy1r nelle femmine, suggerendo l'esistenza di un relè estrogeno-dipendente necessario per garantire il mantenimento dell'omeostasi, che può essere in parte mediato dal recettore Y1 ipotalamico.
Ulteriori studi sono necessari per comprendere meglio la relazione tra estrogeni e il sistema NPY-Y1R nella regolazione delle differenze di sesso nel metabolismo e nelle funzioni legate allo stress.
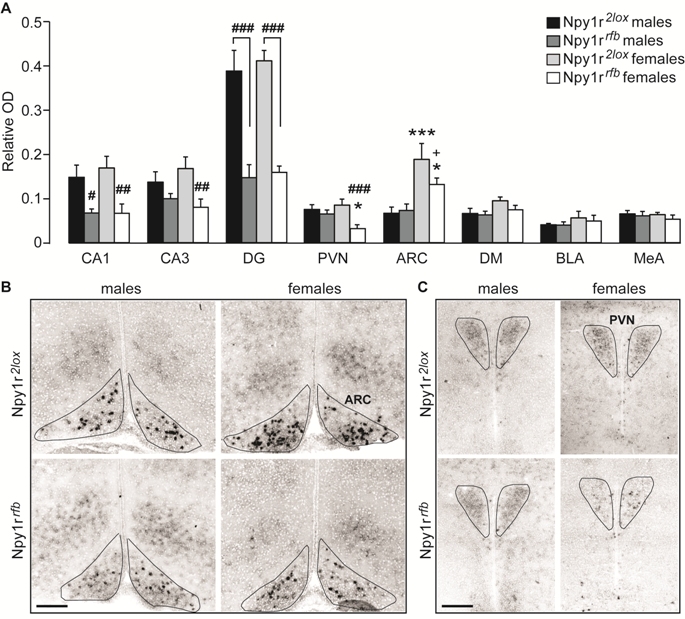
Fig. 1. Espressione dell’mRNA di Npy1r nel cervellodi topi Npy1r2loxe Npy1rrfb di entrambe i sessi. (A) L’analisi dell’intensità di segnale dell’ibridazione in situsemiquantitativa(densità ottica (OD) relativa) rivela una diminuzione significativa dell’mRNA di Npy1r nella CA1, CA3 e DG di topi Npy1rrfbdi entrambe i sessie nel PVN e ARC dei topi Npy1rrfbfemmina ma non maschi, comparati ai rispettivi controlli. Unaumento significativo dell’mRNA di Npy1r è stato osservato nell’ARC di topi femminarispetto ai topi maschi, independentemente dal genotipo. CA1, CA2 e CA3: ###p < 0.001,##p < 0.01 e #p < 0.05 verso i controlli dello stesso sesso, tramite test di Tukey. PVN: ###p = 0.001 verso i controlli femmina e *p < 0.05 verso i topi Npy1rrfb maschi, tramite test di Tukey.ARC: ***p < 0.001 , verso i controlli maschi; *p < 0.05 verso topi Npy1rrfbmaschie +p = 0.051verso i controlli femmina, tramite test di Tukey. I valori sonola media ± SEM.n = 8–6 da 4 a 7 cucciolate. (B e C) Immagine rappresentativa della differenza di intensità di segnale dell’mRNA di Npy1rnell’ARC (B) e nel PVN (C) di topi maschio e femminaNpy1r2loxe Npy1rrfb. Le linee nere mostrano il contorno dei nuclei selezionati e l’area d’interesse (AOI) usataper la quantificazione del segnale mRNA. Barra di calibrazione: 250 μm. CA1, cornu ammonis 1 dell’ippocampo; CA3, cornu ammonis3 dell’ippocampo; DG, giro dentato; PVN, nucleo paraventricolare dell’ipotalamo; ARC, nucleo arcuato dell’ipotalamo; DM, nucleo dorsomediale dell’ipotalamo; BLA, nucleo basolaterale dell’amigdala; MeA, nucleo mediale dell’amigdala.
a Neuroscience Institute of the Cavalieri-Ottolenghi Foundation, 10043 Orbassano, Turin, Italy
b Department of Neuroscience, University of Turin, 10126 Turin, Italy
c Neuroscience Institute of Turin, Italy
d Department of Medicine and Surgery, University of Parma, 43100 Parma, Italy
Agenda
Area Ricercatori
Guarda il video
GiovedìScienza racconta la ricerca al NICO
Vivere per sempre.
Una popolazione sempre più longeva, i suoi problemi e le risposte della ricerca
Hai perso la diretta? Guarda ora il video di GiovedìScienza al NICO: una puntata in diretta dai nostri laboratori dedicata alla ricerca sull'invecchiamento.